产品中心
试剂盒简介:
本试剂盒利用硅羟基磁珠特异吸附核酸原理,配合特定的裂解缓冲液系统快速提取样本总RNA。 广泛应用于植物组织和真菌。
本实验可在1个小时内完成, 整个提取纯化过程不需要添加苯酚及氯仿等有毒试剂,可以直接用于PCR、Southern blotting等下游试验。
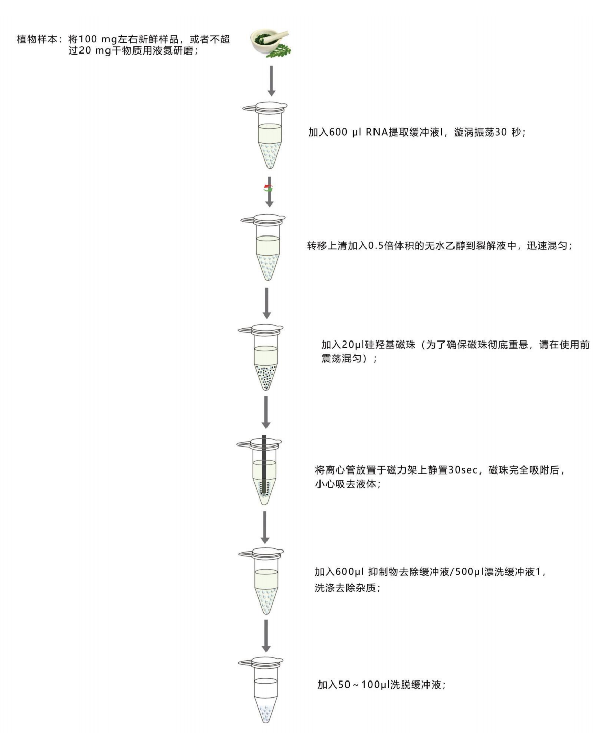
实验流程图(资源处可下载):
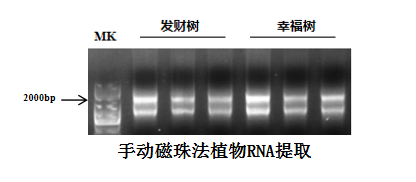
部分实验案例:
上一个:
资 源
常见问题
二:(RNA)如何处理含有微量EDTA的Buffer EB在(RNA)试剂盒中?
试剂盒中Buffer EB(RNA专用)中含有少量EDTA,可能影响下游实验,使用时适当稀释,如果用其他洗脱液洗脱,要确保PH>7.5,PH过低影响洗脱效率;
三:(RNA)离心柱漂洗完成后操作注意事项
离心柱漂洗完成后,尽可能烘干柱膜上残留乙醇,残留乙醇会影响洗脱效率和下游实验效果;柱膜也不建议过度干燥,没有乙醇味道残留最好,如果过度干燥可能影响RNA溶解;如果A260/230值过低,说明样本提取过程中漂洗不彻底,有盐离子残留,建议增加漂洗次数;
四:RNA提取中A260/280比值分析:低于1.9的情况说明什么?
对于RNA提取,A260/280<1.9说明有可能存在DNA污染或者蛋白污染,如果洗脱样本时没有使用Buffer EB,而使用ddH20(确保无RNA酶),比值或偏低,因为Ph值会影响吸光值,并不表示样本纯度低;
五:如何判断RNA的完整性
RNA完整性可以通过超微量核酸检测仪检测或者琼脂糖凝胶电泳(电泳条件:胶浓度1%;1XTAE电泳缓冲液)来判断;一般样本RNA电泳条带为两条带,对于植物样本,有可能存在叶绿体RNA干扰,条带数量大于4条,并不表示RNA提取发生降解;
六:如何有效防止RNA污染?
RNA容易受到环境污染导致RNA严重降解,建议实验过程中注意更换实验手套,使用所有耗材应该均无RNA酶的一次性耗材;
电泳环境受到RNA酶污染,也会造成RNA降解,电泳检测不准确,确保电泳过程中电泳缓冲液,上样缓冲液无RNA酶污染;
七:植物RNA样本处理量差异的处理方案
对于植物样本,样本处理量无法统一确定,对于一般样本(烟草,拟南芥等),提取量不超过100mg鲜重组织或者20mg干重组织,对于复杂样本(水稻,玉米,榆树等),建议初始样本量不超过50mg鲜重或者10mg干重组织;如果需要较高的RNA量,可以采取多管浓缩的方法提取RNA;
如果离心时堵塞离心柱,建议减少初始样本量;
八:植物RNA样本提取试剂盒选型指南
RNA提取一般是传统TRIzol方法和改进的柱式方法;对于TRIzol法进本可以提取大部分样本RNA,但是对于多糖多酚植物样本,建议使用者尽量选择具有针对性的试剂盒(参见目录),传统TRIzol法无法有效去除多糖多酚这些次生代谢物;
相关产品
留言咨询


